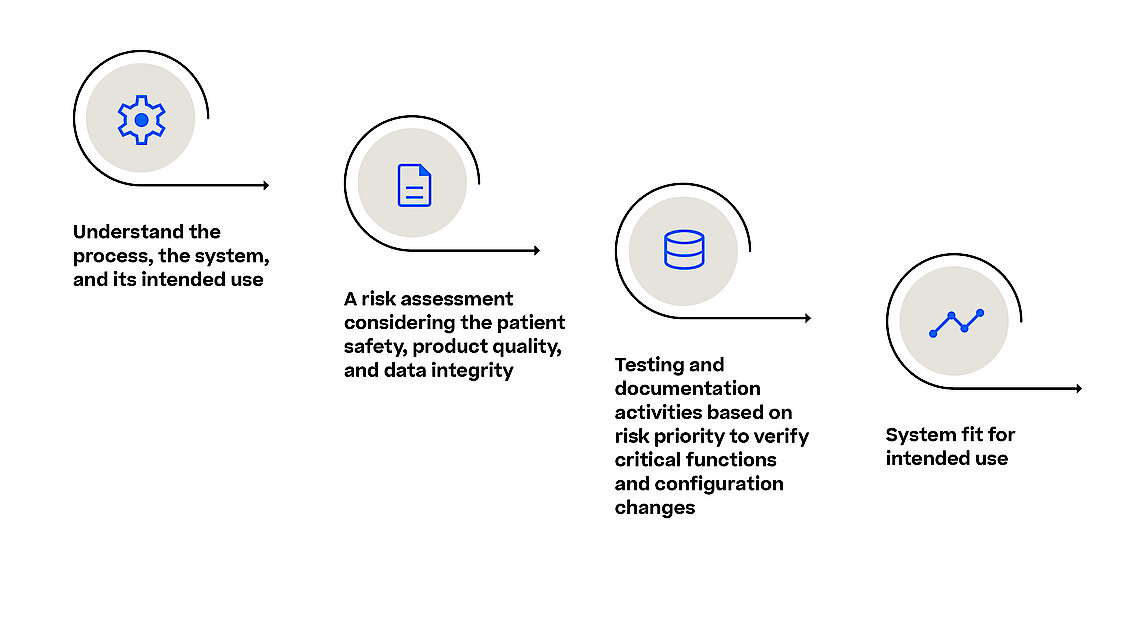
Life Sciences-Unternehmen führen die Validierung von Computersystemen (CSV) gemäß den Validierungsrichtlinien der Food and Drug Administration (FDA) durch. Das Ziel besteht darin sicherzustellen, dass in der Herstellung von regulierten Arzneimitteln und medizinischen Geräten eingesetzte Systeme ihren beabsichtigten Zweck erfüllen und den Anforderungen an die Datenintegrität entsprechen. Für regulierte Unternehmen ist es von entscheidender Bedeutung, sicherzustellen, dass Computersysteme die Kriterien für Funktionalität, Patientensicherheit, Produktqualität und Datenintegrität erfüllen.
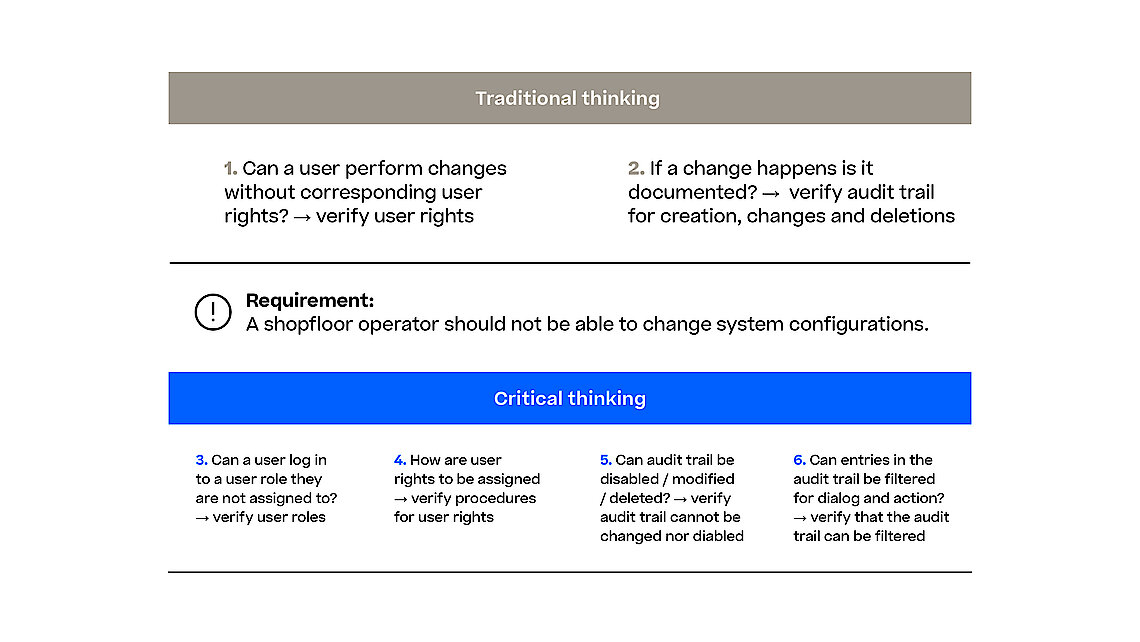
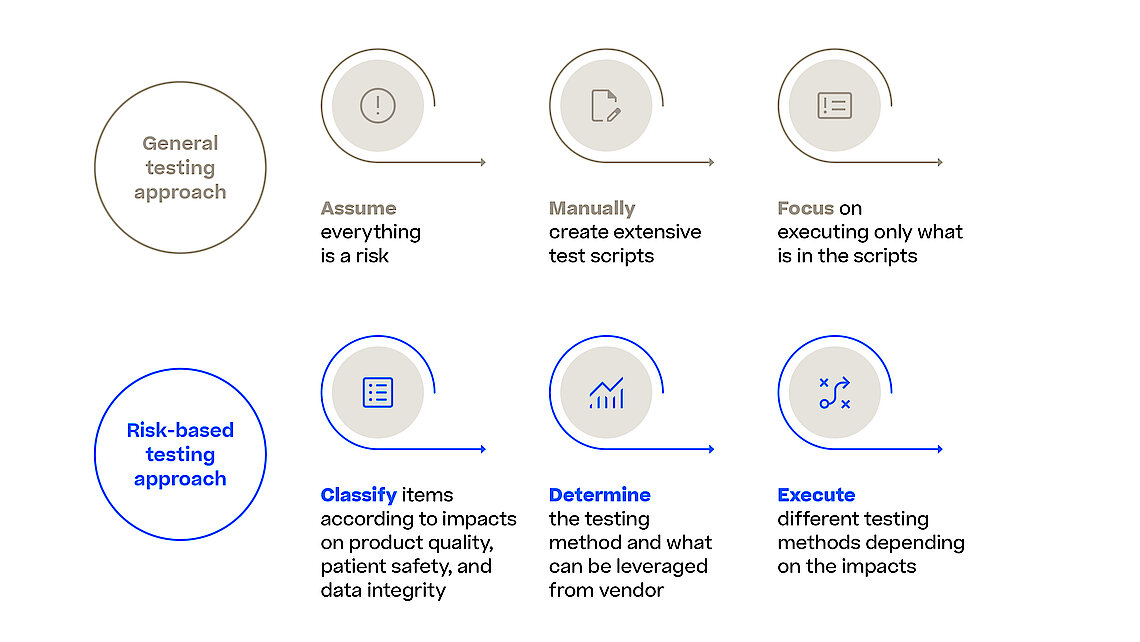
Mit dem Entwurf der Richtlinie zur Computer Software Assurance (CSA) erweitert die FDA die festgelegten Grundsätze zur Softwarevalidierung aus den FDA-Richtlinien zur Softwarevalidierung und drängt die Branche dazu, sich auf die relevantesten und somit risikoreichsten Aspekte in ihren Validierungsbemühungen zu konzentrieren. Dies gilt auch, wenn es darum geht, die Zuverlässigkeit, Sicherheit und Einhaltung von Software-Systemen im Herstellungsprozess sicherzustellen. Ein MES (Manufacturing Execution System) orchestriert und überwacht verschiedene Herstellungsprozesse (z.B. Pharma, Biotech, Advanced Therapy) und jede Software-Störung oder Sicherheitsverletzung kann zu schwerwiegenden Qualitätskontrollproblemen, regulatorischer Nichteinhaltung und potenziellen Gefahren für Patienten führen.