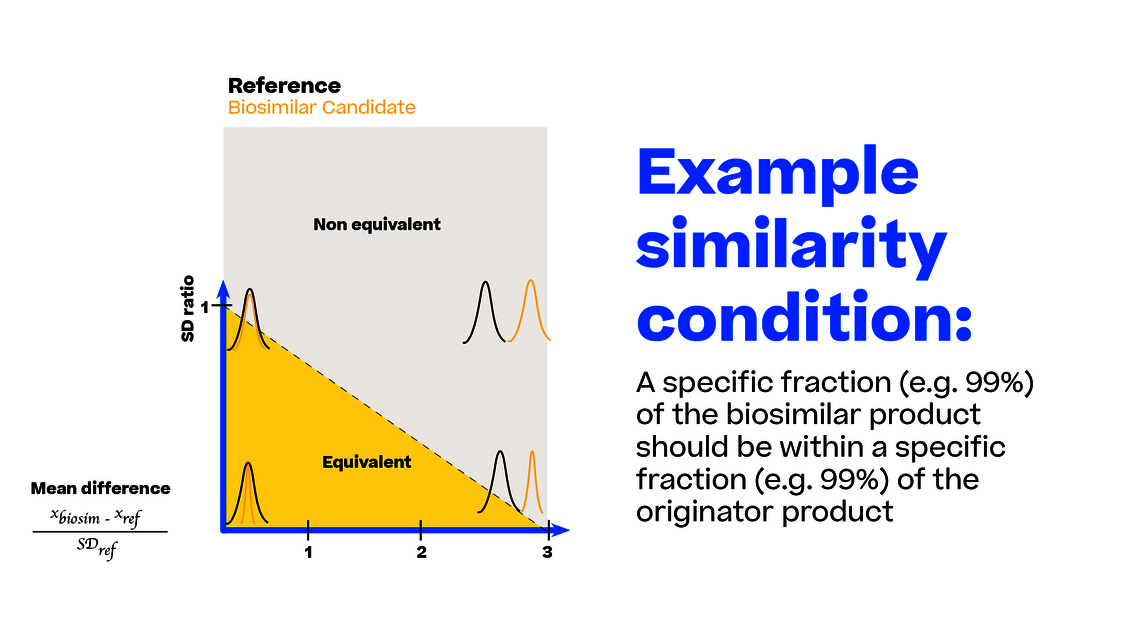
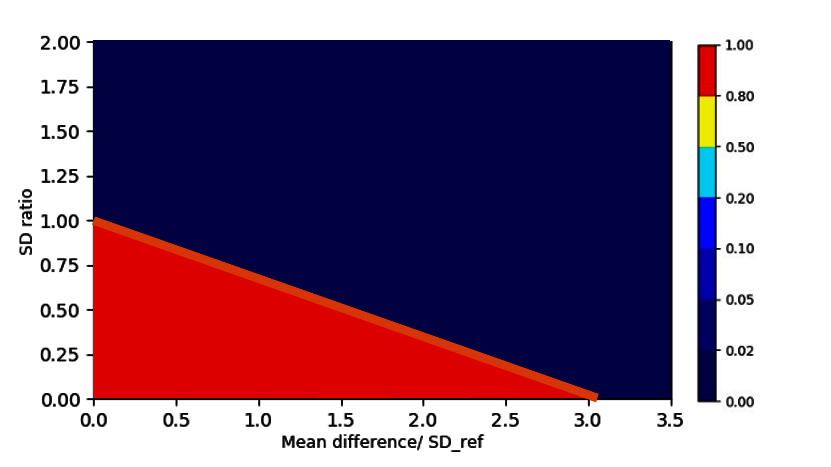
Um die Abweichung verschiedener Tests zu diesem idealen Zustand zu vergleichen, können wir Beispieldaten mit einer gegebenen Stichprobengröße (z. B. 20 Chargen für jedes Biosimilar und das Referenzprodukt) aus einem beliebigen Punkt dieses Koordinatensystems generieren. Denken Sie daran, dass jeder Punkt in diesem Koordinatensystem eine genaue Definition der Biosimilar- und Referenzpopulation (Mittelwert und Standardabweichung) darstellt.
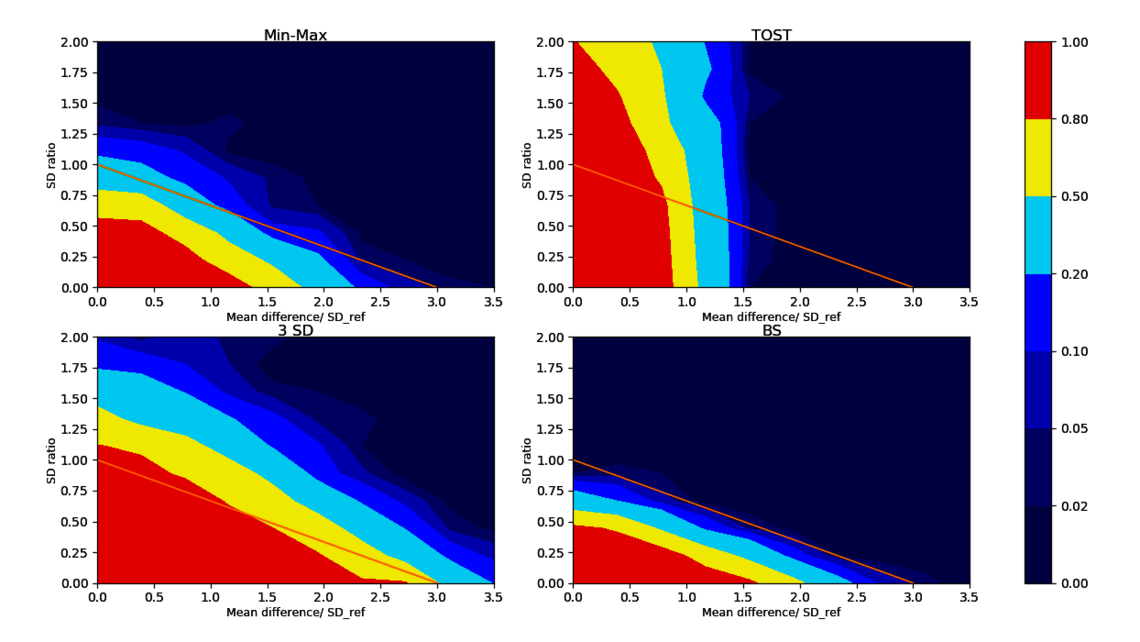
Für jeden oben aufgeführten Test können wir zählen, wie oft der Test die Biosimilarität korrekt akzeptiert/ablehnt. Bei typischen Stichprobengrößen (wie zum Beispiel 20 Chargen jedes Biosimilars und Referenzprodukts) sehen wir in Abbildung 3 die Akzeptanzrate für Biosimilarität in verschiedenen Szenarien für verschiedene Tests.
Vergleichen wir den Bootstrap-Test mit dem häufig angewendeten 3-SD-Test: Wie wir in der unteren linken Ecke von Abbildung 3 sehen, akzeptiert der 3-SD-Test in großen Bereichen der Nichtäquivalenzregionen Biosimilarität, wie durch den großen roten und gelben Anteil außerhalb der Ähnlichkeitsbedingung angezeigt. Dies birgt ein hohes regulatorisches Risiko, falsch als biosimilar akzeptierte Kandidaten, die tatsächlich nicht biosimilar sind. Darüber hinaus ist dieser Test fehlerhaft, da es einfacher wird, ihn zu bestehen, wenn die Stichprobengröße der Biosimilar-Daten abnimmt³ ⁴ ⁷. Die gleiche Situation gilt für den Min-Max-Test (oben links von Abbildung 3).
Wie in der oberen rechten Ecke von Abbildung 3 gezeigt wird, prüft der Äquivalenztest TOST nur auf den Unterschied der Mittelwerte (x-Achse), akzeptiert jedoch auch fälschlicherweise Biosimilarität (rote Bereiche), wenn die Standardabweichung der Biosimilar-Population wesentlich größer ist als die Standardabweichung des Referenzprodukts (hohe y-Werte in unserem Koordinatensystem).